الأكسجين هو الهواء الذي تتنفسه الكائنات الحية لضمان إستمرار بقائها علي كوكب الأرض حيث تقوم بإمتصاصه و تحويله إلي غاز ثاني أكسيد الكربون و حال إنعدامه فيؤدي ذلك إلي إنعدام الحياة و هو عنصر كيميائي غير معدني يرمز إليه بالرمز (O) و رقمه الذري في الجدول الدوري (8) و هو عضو في مجموعة الكالكوجين و يتميز بأنه غاز عديم اللون و الرائحة و المذاق و عنصر شديد التفاعل نظرا لأنه يشكل مركبات كيميائية تنتج من إختلاطه مع عناصر أخري حيث يعتبر الماء أحد أهم تلك المركبات كما يقوم من خلال تفاعلات أخري بإزاحة عناصر من مجموعاتها و في كثير من الحالات تكون مصحوبة بظهور حرارة و ضوء و تسمي حينها الإحتراق و رغم أهمية الأكسجين في إستمرار الحياة إلا أنه يستخدم أيضا فى الأغراض التجارية التي تشمل صناعات الصلب و البلاستيك و المنسوجات و الوقود الصاروخي و الأغراض الطبية مثل العلاج بالأكسجين و في العمليات الجراحية إضافة إلي وجوده في أنظمة دعم الحياة داخل الطائرات و الغواصات و المركبات الفضائية .
و رغم وجود الأكسجين منذ بدء الخليقة إلا أنه تم إكتشافه عام 1772 علي يد الكيميائي السويدي “كارل فيلهلم شيل” الذي حصل عليه عن طريق تسخين نترات البوتاسيوم و أكسيد الزئبق و العديد من المواد الأخرى كما أكتشف الكيميائي الإنجليزي “جوزيف بريستلي” غاز الأكسجين بشكل مستقل عام 1774 عن طريق التحلل الحراري لأكسيد الزئبق و و قام بنشر تلك النتائج في نفس العام و خلال الفترة ما بين 1775-1780 فسر الكيميائي الفرنسي “أنطوان لوران لافوازييه” ببصيرة ملحوظة دور الأكسجين في عملية التنفس للكائنات الحية و كذلك في الاحتراق متجاهلًا نظرية اللاهوب التي كانت مقبولة فى ذلك الوقت و تتحدث عن أن الإحتراق ينتج من داخل المواد المحترقة ذاتها حيث أشار أنها تحدث من خلال تكون الأحماض الناتجة من دمج العديد من المواد و العناصر المختلفة و هو السبب الذي أطلق علي ذلك العنصر إسم ” الأكسجين ” نسبة إلي كلمة يونانية تعني ” حمض سابق ” .

و يتميز غاز الأكسجين بأنه غاز لا لون له و لكن عند درجة حرارة أقل من -183 درجة مئوية يصبح سائل ذات لون أزرق و شاحب كما يتحول إلي الحالة الصلبة عند حوالي – 218 درجة مئوية و يعد هو العنصر الأكثر وفرة في القشرة الأرضية حيث يتواجد بنسبة 46% من كتلتها و يمثل 21% في الغلاف الجوي أما وزنه في مياه البحار فيصل إلي 89% و بالنسبة للصخور فيكون مدمج مع المعادن و اللافلزات في شكل أكاسيد حمضية مثل الكبريت و الكربون و الألمنيوم و الفوسفور أو أكاسيد قاعدية مثل الكالسيوم و المغنيسيوم و الحديد أو كمركبات شبيهة بالملح التي يمكن إعتبارها مكونة من الأكاسيد الحمضية و القاعدية مثل الكبريتات و الكربونات و السيليكات و الألومينات و الفوسفات و رغم توفر هذه المركبات الصلبة إلا أنها ليست مفيدة كمصادر لغاز الأكسجين لأن محاولة فصل ذلك العنصر عن تلك المجموعات قد تكون مكلفة للغاية و يعد الأكسجين الطبيعي مزيج من ثلاثة نظائر مستقرة و هم الأكسجين16 (99.759٪) و الأكسجين17 (0.037٪) و الأكسجين18 (0.204٪) و في بعض من الأحيان يتم إستخدام الأكسجين15 الأطول عمرا لدراسة التنفس في الثدييات.
و أثناء تنفس الأكسجين تقوم الكائنات الحية من بشر و حيوانات و حتي البكتيريا بإستنشاقه من الغلاف الجوي أثناء عملية الشهيق و بعد الإستفادة منه يتم تحويله إلي غاز ثاني أكسيد الكربون و الذي يتم طرده بواسطة عملية الزفير لتقوم النباتات الخضراء بإمتصاص ذلك الغاز من خلال عملية التمثيل الضوئي في وجود ضوء الشمس ثم تقوم بتحويله إلي الأكسجين مجددا و إطلاقه للغلاف الجوي حيث يذوب حوالي 3 أجزاء من الأكسجين من حيث الحجم في 100 جزء من الماء العذب عند 20 درجة مئوية و أقل قليلاً في مياه البحر و يعد الأكسجين المذاب ضروري لتنفس الأسماك و الحياة البحرية الأخرى .
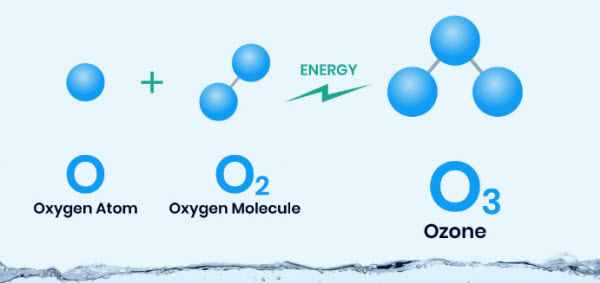
و كيميائيا فيوجد لغاز الأكسجين شكلين متآصلين و هم ثنائي الذرة (O2) و ثلاثي الذرة (O3) و المعروف بإسم ” الأوزون ” و هو غاز لونه أزرق فاتح و كثافته 1.658 ضعف كثافة الهواء و درجة غليانه عند −112 درجة مئوية و ينتج عن طريق تعريض الأكسجين النقي لعملية تفريغ كهربائي صامت و لذلك يمكن ملاحظة رائحته النفاذة في المناطق التي يوجد بها شرر من المعدات الكهربائية كما هو الحال في غرف المولدات كما ينتج أيضا من خلال إمتصاص الضوء فوق البنفسجي لأطوال موجية تقدر بـ 250 نانومتر و هي العملية التي تحدث في الغلاف الجوي العلوي و تقوم بإزالة الإشعاعات التي من شأنها أن تضر بالحياة على سطح كوكب الأرض و يعد الأوزون عامل مؤكسد قوي و قادر على تحويل ثاني أكسيد الكبريت إلى ثالث أكسيد الكبريت و الكبريتيدات إلى كبريتات و العديد من المركبات العضوية إلى مشتقات مؤكسجة مثل الألدهيدات و الأحماض و تجاريًا يتم استخدامه ككاشف كيميائي و كمطهر في معالجة مياه الصرف الصحي و تنقية المياه و تبييض المنسوجات .
و يتم إنتاج غاز الأكسجين مخبريا بطرق مختلفة و تعتمد طرق الإنتاج المختارة على كمية العنصر المطلوب و من أبرزها :
1- التحلل الحراري لبعض الأملاح مثل كلورات البوتاسيوم أو نترات البوتاسيوم حيث يتم تحفيز تحلل كلورات البوتاسيوم بواسطة أكاسيد المعادن الإنتقالية و كثيرا ما يستخدم ثاني أكسيد المنجنيز في تلك الحالات حيث يقوم بتقليل درجة الحرارة اللازمة لتأثير تطور الأكسجين من 400 درجة مئوية إلى 250 درجة مئوية بواسطة ذلك المحفز .
2- التحلل الحراري لأكاسيد المعادن الثقيلة و هى الخطوات التي أتبعها العلماء ” كارل فيلهلم شيل ” و ” جوزيف بريستلي ” لإنتاج الأكسجين عن طريق استخدام أكسيد الزئبق .
3- التحلل الحراري لبيروكسيدات الفلزات أو بيروكسيد الهيدروجين و هو كان إجراء تجاري مبكر لعزل الأكسجين عن الغلاف الجوي .
4- التحليل الكهربائي للماء الذي يحتوي على نسب صغيرة من الأملاح أو الأحماض حيث تستخدم الكهرباء فى تلك العملية لفصل مركب المياه إلي غازي الهيدروجين و الأكسجين .

و في حال أردنا الحصول علي كميات ضخمة من الأكسجين فيتم ذلك بالتقطير الجزئي للهواء السائل فمن بين المكونات الرئيسية للهواء يحتوي ذلك الغاز على أعلى نقطة غليان و بالتالي فيكون أقل تطايرًا من النيتروجين و الأرجون حيث تكون الخطوات كالتالي (1) يتم ترشيح الهواء لإزالة الجسيمات العالقة فيه (2) تتم إزالة الرطوبة و ثاني أكسيد الكربون عن طريق عملية الإمتصاص في القلويات (3) يتم ضغط الهواء و إزالة حرارة الإنضغاط بواسطة إجراءات التبريد العادية (4) يتم تمرير الهواء المضغوط و المبرد إلى ملفات موجودة في الغرفة (5) يُسمح لجزء من الهواء المضغوط (عند حوالي 200 ضغط جوي) بالتمدد في الغرفة مما يؤدي إلى تبريد الملفات (6) يتم إرجاع الغاز الممدد إلى الضاغط أو الكومبرسور و مع عدة خطوات تمدد و إنضغاط لاحقة تؤدي في النهاية إلى تسييل الهواء المضغوط عند درجة حرارة -196 درجة مئوية (7) يُسمح للهواء السائل بالتدفئة لتقطير الغازات النادرة الخفيفة أولاً ثم النيتروجين تاركًا الأكسجين السائل فقط حيث يكون نقيا جدا بنسبة 99.5% و يستغل في معظم الأغراض الصناعية .
و تعتبر صناعة الصلب حاليا هي أكبر مستهلك للأكسجين النقي من خلال الإعتماد عليه في نفخ الفولاذ عالي الكربون و هو ما يؤدي إلي تطاير ثاني أكسيد الكربون و الشوائب غير المعدنية الأخرى حيث يتميز الإعتماد عليه بأنه يكون أكثر سرعة و سهولة في التحكم مما لو تم استخدام الهواء العادي كما تعتبر معالجة النفايات السائلة الموجودة في مياه الصرف الصحي بالأكسجين أفضل كثيرا من العمليات الكيميائية الأخرى و أيضا حرق النفايات في أنظمة مغلقة كما يستخدم الاكسجين النقي أيضا في أعمال الفضاء من خلال الوقود المؤكسد للصواريخ و المكون منه إضافة إلي إستخدامه كعامل دعم داخل الغواصات و الطائرات و مركبات الفضاء و خزانات الغواصين أسفل المياه كما أن له عدد من الإستخدامات الطبية التي تشمل خيام الأكسجين و أجهزة الاستنشاق و حضانات الأطفال كما يضمن التخدير الغازي المخصب بالأكسجين دعم الحياة أثناء التخدير العام خلال إجراء العمليات الجراحية .

