قالها الله في محكم كتابه ( و جعلنا من الماء كل شئ حي ) و عليه فيعتبر الماء هو أساس الحياة و من دونه لا أحد يستطيع العيش فمنه يرتوي الإنسان لضمان صحة بدنه و أعضائه كما يعتمد عليه في أعمال الزراعة لتلبية الإحتياجات الغذائية الضرورية للبشر إضافة إلي أنه يعد وسيلة هامة للنظافة و الطهارة و بالتالي الحماية من الأمراض و الأوبئة و هو يتميز بأنه سائل لا طعم له و لا لون و لا رائحة و لديه قدرة كبيرة علي إذابة العديد من المواد الأخري و يتكون من عنصرين كيميائيين هم الهيدروجين و الأكسجين و يتواجد في عالمنا بحالاته الثلاث الغازية و السائلة و الصلبة و هو يعد من أكثر المركبات وفرة و ضرورية و لا يقتصر وجوده علي كوكب الأرض فحسب بل أشارت الإستكشافات إلي وجود كميات منه بنسب متفاوتة علي الكواكب و الأقمار الأخرى داخل المجموعة الشمسية و خارجها .
و على الرغم من أن جزيئات الماء بسيطة في تركيبها (H2O) إلا أن الخواص الفيزيائية و الكيميائية لديه معقدة للغاية و تعد ليست نموذجية لمعظم المواد الموجودة على الأرض فعلى سبيل المثال كثير ما نري مكعبات الثلج تطفو في كوب من الماء المثلج إلا أن مثل هذا السلوك غير معتاد بالنسبة للمركبات الكيميائية الأخري تقريبًا و التي تكون فيها الحالة الصلبة أكثر كثافة من الحالة السائلة و بالتالي فإن المادة الصلبة تغوص في قاع السائل إلا أن الموضوع مختلف في حالة الماء و يكفي حقيقة طفو الجليد فوق البرك و البحيرات في المناطق الباردة من العالم و الذي يعمل كحاجز عازل يحمي الحياة المائية أدناه و الذي إذا كان أتبع الحقائق الفيزيائية الطبيعية لكن من المفترض أن يغوص في الأسفل مما يعرض المزيد من الماء لدرجات الحرارة الباردة و بالتالي ستتجمد البركة في نهاية المطاف بشكل يؤدي إلى مقتل جميع أشكال الحياة الموجودة فيها .

و يوجد الماء في معظم أوقاته في الظروف العادية بهيئة سائل على سطح الأرض مما يجعله موطن لعدد لا يحصى من النباتات و الحيوانات كما أن حقيقة تحوله بسهولة إلى بخار (غاز) تسمح له بالإنتقال عبر الغلاف الجوي من المحيطات إلى المناطق الداخلية حيث يتكثف و يهبط على شكل أمطار تغذي الحياة النباتية و الحيوانية و بسبب أهميته لعب منذ فترة طويلة دورًا دينيًا و فلسفيًا مهمًا في تاريخ البشرية ففي القرن السادس قبل الميلاد أعتبره “طاليس” الذي يُنسب إليه أحيانًا الفضل في بدء الفلسفة اليونانية بأنه لبنة البناء الأساسية الوحيدة للمادة حيث قال أنه بأشكاله المختلفة هو ما يشكل الأرض و الغلاف الجوي و السماء و الجبال و الآلهة و البشر و الوحوش و الطيور و العشب و الأشجار و الحيوانات حتى الديدان و الذباب و النمل و بعد مائتي عام أعتبره “أرسطو” أحد العناصر الأساسية الأربعة بجانب الأرض و الهواء و النار و أستمر الإعتقاد بأنه مادة أساسية لأكثر من 2000 عام حتى أظهرت التجارب في النصف الثاني من القرن الثامن عشر أنه مركب يتكون من عنصري الهيدروجين و الأكسجين .
و في عالمنا يوجد الماء بشكل رئيسي في المحيطات بنسبة (97.25%) إضافة إلي وجوده في القمم الجليدية و الأنهار الجليدية القطبية بنسبة (2.05%) و الباقي موزع علي بحيرات المياه العذبة و الأنهار و المياه الجوفية و مع نمو سكان الأرض و زيادة الطلب على المياه العذبة أصبحت تنقية الماء و إعادة تدويره ذات أهمية متزايدة و من المثير للإهتمام أن متطلبات نقاء المياه للإستخدام الصناعي غالبا ما تتجاوز متطلبات الاستهلاك البشري فعلى سبيل المثال يجب أن تكون المياه المستخدمة في الغلايات ذات الضغط العالي نقية بنسبة 99.999998 بالمائة على الأقل و نظرًا لاحتواء مياه البحار على كميات كبيرة من الأملاح الذائبة فيجب تحليتها أولا لمختلف الإستخدامات بما في ذلك الاستهلاك البشري .
تركيب الماء
الحالة السائلة … يتكون جزيء الماء من ذرتي هيدروجين ترتبط كل منهما برابطة كيميائية واحدة مع ذرة الأكسجين و تحتوي معظم ذرات الهيدروجين على نواة تتكون من بروتون واحد و نيوترون و هناك أيضا نظائر له و هم الديوتيريوم و التريتيوم و اللتان تحتوي نواتهم علي نيوترونين و يعتبر أكسيد الديوتيريوم (D2O) الذي يسمى بالماء الثقيل مهمًا في الأبحاث الكيميائية و يستخدم كمهدئ للنيوترونات في بعض المفاعلات النووية و على الرغم من أن صيغته (H2O) قد تبدو بسيطة إلا أنه يظهر خصائص كيميائية و فيزيائية معقدة للغاية فعلى سبيل المثال نقطة إنصهاره هي 0 درجة مئوية و نقطة الغليان 100 درجة مئوية و هي أعلى بكثير مما هو متوقع بالمقارنة مع المركبات المماثلة مثل كبريتيد الهيدروجين و الأمونيا كما أنه في حالته الصلبة أي الجليد يكون أقل كثافة منه عندما يكون سائلاً و هي خاصية أخرى غير عادية و يرجع تلك الحالات الشاذة إلي التركيب الإلكتروني لجزيء الماء أما بالنسبة للأكسجين فتحتوي ذرته على ستة إلكترونات في غلافها الخارجي لذلك عندما تشكل ذرة الأكسجين رابطة كيميائية واحدة، فإنها تشترك في أحد إلكتروناتها مع نواة ذرة أخرى و تتلقى في المقابل حصة من الإلكترون من تلك الذرة و عند الإرتباط بذرتي هيدروجين يمتلئ الغلاف الإلكتروني الخارجي لذرة الأكسجين .
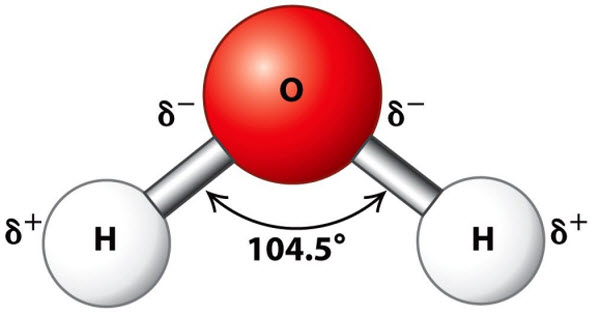
و كيميائيا فيعتبر جزئ الماء ليس خطيًا و لكنه منحني بطريقة خاصة حيث ترتبط ذرتا الهيدروجين بذرة الأكسجين بزاوية قدرها 104.5 درجة كما أن طول الرابطة بينهم هي 95.7 بيكومتر و نظرًا لأن ذرة الأكسجين لديها سالبية كهربية أكبر من ذرة الهيدروجين، فإن روابط O―H في جزيء الماء تكون قطبية حيث يحمل الأكسجين شحنة سالبة جزئية (δ−) بينما الهيدروجين له شحنة جزئية موجبة (δ+) و بالتالي تنجذب ذرات الهيدروجين الموجودة في جزيئات الماء إلى المناطق ذات الكثافة الإلكترونية العالية و يمكن أن تشكل روابط ضعيفة تسمى روابط الهيدروجين مع تلك المناطق و هذا يعني أن ذرات الهيدروجين الموجودة في جزيء ماء واحد تنجذب إلى أزواج الإلكترونات غير المترابطة لذرة الأكسجين الموجودة في جزيء الماء المجاور و يُعتقد أن بنية الماء السائل تتكون بمجاميع من جزيئات الماء التي تتشكل بإستمرار و هذا ما يفسر خصائصه الأخرى غير العادية مثل اللزوجة العالية و التوتر السطحي.
الجليد و الثلوج .. في الحالة الصلبة (الجليد) تؤدي التفاعلات بين الجزيئات إلى بنية منظمة للغاية و لكنها فضفاضة حيث تكون كل ذرة أكسجين محاطة بأربع ذرات هيدروجين منهم إثنتان من ذرات الهيدروجين مرتبطة تساهميًا بذرة الأكسجين و الإثنتين الأخريين (على مسافات أطول) مرتبطتان بالهيدروجين بأزواج الإلكترونات غير المشتركة لذرة الأكسجين حيث يتسبب هذا الهيكل المفتوح للجليد في أن تكون كثافته أقل من كثافة الحالة السائلة حيث يتحلل الهيكل المنظم جزئيًا و تكون جزيئات الماء (في المتوسط) أقرب إلى بعضها البعض و عندما يتجمد الماء من الممكن حدوث مجموعة متنوعة من الهياكل إعتمادًا على الظروف و من المعروف أن هناك ثمانية عشر شكلاً مختلفًا من الجليد يعتمد تشكلها علي طبيعة الإختلاف في الضغط الخارجي و درجة الحرارة .

أهمية هيكل الحالة السائلة .. تتمتع الحالة السائلة للماء ببنية معقدة للغاية و التي تتضمن إرتباطًا كبيرًا بين الجزيئات فالروابط الهيدروجينية الواسعة بين جزيئات الماء السائل تنتج قيمًا أكبر بكثير لخصائص مثل اللزوجة و التوتر السطحي و نقطة الغليان مما هو متوقع لسائل نموذجي يحتوي على جزيئات صغيرة فعلى سبيل المثال و بناءً على حجم جزيئاته كان من المفترض أن تكون نقطة غليان الماء أقل بحوالي 200 درجة مئوية من نقطة الغليان الملحوظة .
و تلعب قطبية جزيء الماء دورًا رئيسيًا في إذابة المركبات الأيونية أثناء تكوين المحاليل المائية حيث تحتوي محيطات الأرض على كميات هائلة من الأملاح الذائبة التي توفر مورداً طبيعياً عظيماً كما أن مئات التفاعلات الكيميائية التي تحدث في كل لحظة تعمل علي إبقاء الكائنات الحية على قيد الحياة و التي تحدث جميعها في السوائل المائية كما أن قدرة الأطعمة على إضفاء النكهة أثناء طهيها أصبحت ممكنة بفضل ذوبان مواد مثل السكر و الملح في الماء و على الرغم من أن قابلية ذوبان المواد هي عملية معقدة للغاية إلا أن التفاعل بين جزيئات الماء القطبية و المذاب (أي المادة التي يتم إذابتها) تلعب دورًا رئيسيًا فعندما تذوب مادة صلبة أيونية في الماء تنجذب الأطراف الموجبة لجزيئات الماء إلى الأيونات بينما تنجذب أطرافها السالبة إلى الكاتيونات و هذه العملية تسمى الترطيب حيث يميل ترطيب الأيونات إلى التسبب في تفكك و ذوبان الملح في الماء و يتم إستبدال القوى القوية الموجودة بين الأيونات الموجبة و السالبة للمادة الصلبة بتفاعلات أيونات الماء القوية .

و بجانب ما سبق توجد أيضا العديد من المركبات غير الأيونية القابلة للذوبان فعلى سبيل المثال مادة الإيثانول (C2H5OH) و هي المكون الكحولي للنبيذ و البيرة و المشروبات الروحية المقطرة تعد قابلة للذوبان بدرجة عالية بسبب بنية جزيء الكحول حيث يحتوي الجزيء على رابطة O―H قطبية مثل تلك الموجودة في الماء مما يسمح له بالتفاعل بفعالية مع الماء و لكن علي النقيض من ذلك هناك العديد من المواد التي لا يعتبر الماء مذيبًا مقبولاً لها فالدهون الحيوانية على سبيل المثال غير قابلة للذوبان في الماء النقي لأن الطبيعة غير القطبية لجزيئات الدهون تجعلها غير متوافقة مع جزيئاته القطبية .
خصائص الماء
في حالة الضغط و درجة الحرارة المرتفعة .. تتغير القدرة المميزة للماء على التصرف كمذيب قطبي (وسط ذوبان) عندما يتعرض لدرجات حرارة و ضغوط عالية فعندما يصبح الماء أكثر سخونة تبدو الجزيئات أكثر عرضة للتفاعل مع الجزيئات غير القطبية فعلى سبيل المثال عند درجة حرارة 300 درجة مئوية و ضغط مرتفع يكون له خصائص إذابة مشابهة جدًا للأسيتون (CH3COCH3) و هو مذيب عضوي شائع كما يُظهر سلوكًا غير عادي حين يتجاوز درجة الحرارة و الضغط الحرج (374 درجة مئوية و 218 ضغطًا جويًا) حيث يختفي التمييز بين الحالة السائلة و الغازية للمياه و يصبح مائعًا فوق حرج و يمكن أن تختلف كثافته من شبيه بالسائل إلى شبيه بالغاز عن طريق تغيير درجة حرارته و ضغطه و إذا كانت كثافة الماء فوق الحرج عالية بما فيه الكفاية فإن المواد المذابة الأيونية تكون قابلة للذوبان بسهولة كما هو الحال بالنسبة للمياه “العادية” و لكن من المثير للدهشة أن هذا السائل فوق الحرج يمكنه أيضًا إذابة المواد غير القطبية بسهولة و هو أمر لا يستطيع الماء العادي فعله و نتيجة قدرته على إذابة المواد غير القطبية فيمكن إستخدام الماء فوق الحرج كوسيلة إحتراق لتدمير النفايات السامة فعلى سبيل المثال يمكن خلط النفايات العضوية مع الأكسجين في ماء فوق حرج كثيف بدرجة كافية و حرقها في ذلك السائل كما يمكن إستخدام الأكسدة في الماء فوق الحرج لتدمير مجموعة واسعة من المواد العضوية الخطرة مع ميزة أن مفاعل الماء فوق الحرج هو نظام مغلق لذلك لا توجد إنبعاثات إلي الغلاف الجوي .

الخصائص الفيزيائية .. لدي الماء العديد من الخصائص الفيزيائية الهامة فنظرًا للكتلة المولية المنخفضة للجزيئات المكونة له فهو يتمتع بقيم كبيرة بشكل غير عادي من اللزوجة و التوتر السطحي و حرارة التبخر و أنتروبيا التبخر و كلها يمكن أن تعزى إلى تفاعلات الروابط الهيدروجينية الواسعة الموجودة في الصورة السائلة و يفسر الهيكل المفتوح للجليد الذي يسمح بأقصى قدر من الروابط الهيدروجينية سبب كون الماء الصلب أقل كثافة من السائل و هو وضع غير عادي للغاية بين المواد الشائعة و تعد أبرز خصائصه الفيزيائية هي كالتالي :
- الكتلة المولية 18.0151 جرام لكل مول .
- نقطة الانصهار 0.00 درجة مئوية .
- نقطة الغليان 100.00 درجة مئوية .
- الكثافة القصوى (عند 3.98 درجة مئوية) 1.0000 جرام لكل سنتيمتر مكعب .
- الكثافة (عند 25 درجة مئوية) 0.99701 جرام لكل سنتيمتر مكعب .
- ضغط البخار (25 درجة مئوية) 23.75 تور .
- حرارة الانصهار (0 درجة مئوية) 6.010 كيلو جول لكل مول .
- حرارة التبخر (100 درجة مئوية) 40.65 كيلوجول لكل مول .
- حرارة التكوين (25 درجة مئوية) -285.85 كيلو جول لكل مول .
- إنتروبيا التبخر (25 درجة مئوية) 118.8 جول لكل درجة مئوية مول .
- اللزوجة 0.8903 مئوية .
- التوتر السطحي (25 درجة مئوية) 71.97 داين لكل سنتيمتر .
